岳阳市中心医院药物临床试验开展流程及注意事项(附件:![]() 药物临床试验开展流程附件.rar)
药物临床试验开展流程附件.rar)
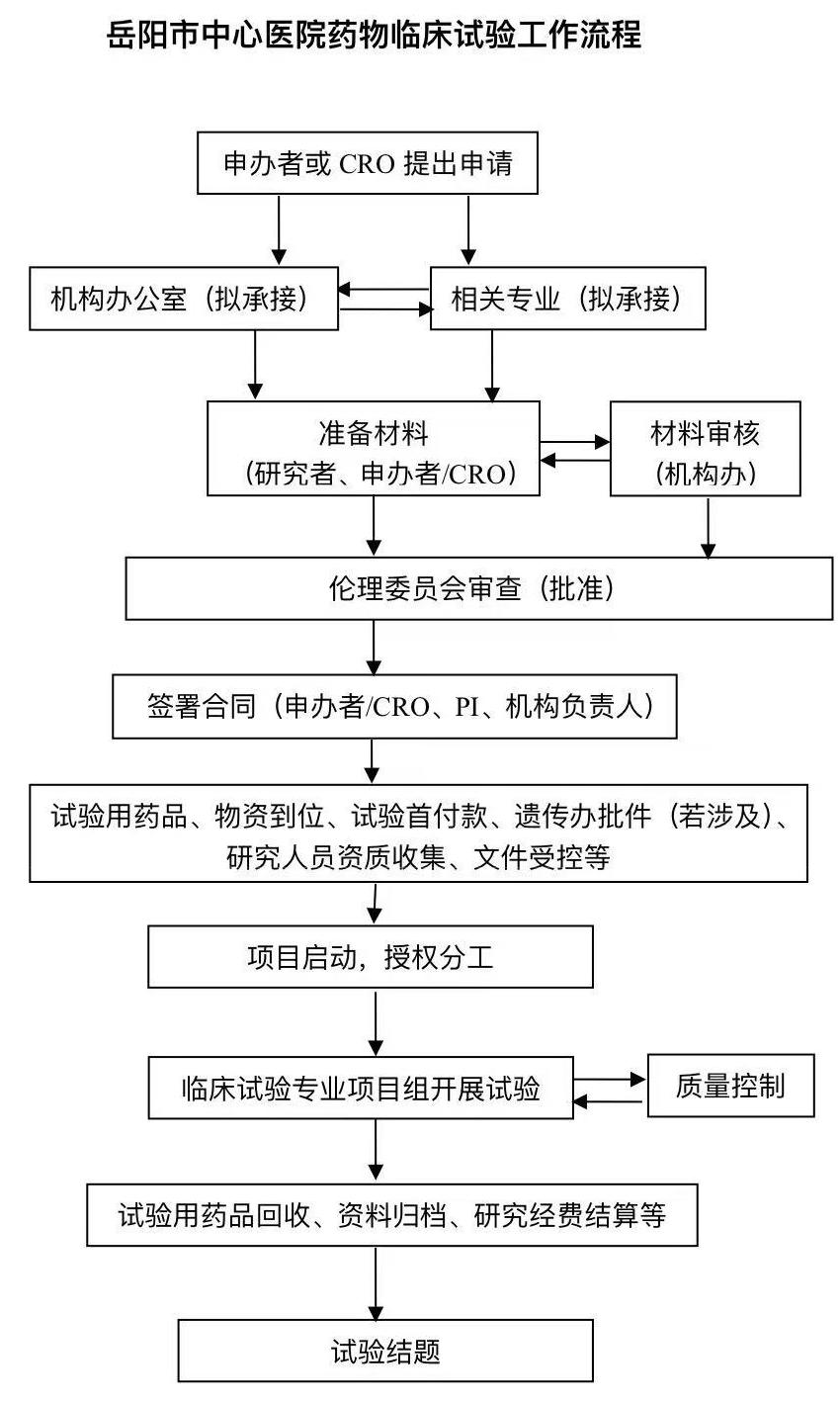
1、 临床试验申请:申办者/CRO拟在我院开展药物临床试验研究项目,请先与药物临床试验机构办公室(GCP办)联系(电话:0730-8357843,邮箱:YYSYGCP@126.com)。
2、立项审查:申请人将电子版《药物临床试验申请表》(附件1)和立项资料电子版(参照《药物临床试验立项文件清单》(附件2))发送至机构邮箱进行初步审查,初审后GCP项目管理员以邮件形式告知需要补充的资料,申请人再递交一套完整版纸质文件(签字或盖章原件)进行正式立项,GCP办给予立项编号格式YYCHDT+年度+立项数(如:YYCHDT2024001)。(注:机构立项编号为财务管理、受试者免费检查以及开展过程唯一识别码)
3、人遗资料审查:涉及人类遗传资源研究需要收集本院承诺书的临床试验,需要递交表格《关于人类遗传资源申请资料真实性承诺书》(附件4)、《临床研究项目涉及人类遗传资源管理信息登记表》(附件5)进行申请,在立项审查通过后GCP办可协助完成签字;若不涉及人类遗传资源研究则出具鲜章说明,存于立项清单其他项中。
4、研究合同/协议签署:在电子版立项审查的同时可将合同/协议(主协议、CRC协议)电子版发送给主要研究者(PI)初步审核,经PI初步认可(邮件或微信截图)后,可递交至机构办、法制科进行审核,经商议协议方达成一致后,申请方(申办者/CRO)完成纸质版协议签字后递交至主要研究者,PI签署协议及会签单(附件6)后递交至机构办公室,机构办公室协助完成协议签署(注:CRC协议的审核、签署与主协议保持同步)。
5、临床试验药物管理:协议签署后储存GCP药房的试验用药品寄送前需要向机构办递交《临床试验药品管理模式评估表》(附件7),寄送前需提前与药品管理员联系;储存于临床科室药品室的试验用药品配送或回收应及时告知科室药品管理员、CRC、机构管理员三方清点确认。试验过程中若涉及试验药物调入调出使用《试验用药品调入(出)申请表》(附件8)进行申请,批准后方能进行试验药物的调入或调出。
6、项目启动会:启动会准备事项①已支付首款,提供付款凭证(支付费用时,打款备注需添加机构项目立项编号以及付款内容),②GCP药房或相关专业收到试验用药品、相关研究资料,③获得“人类遗传资源采集、收集、买卖、出口、出境审批决定”(如适用),④拟授权人员(预填写电子版授权表及授权内容)资质收集审核,其中简历模板建议使用机构版本(附件9),⑤GCP办已对项目组重要文件(如知情同意书、药品管理表格等)审核并对纸质文件进行受控,⑥研究人员(研究者、研究护士、CRC)已签署机构的保密承诺书和利益冲突声明(附件3),⑦告知GCP办药物临床试验登记与信息公示平台登记号,⑧项目经费管理账本确认等;启动会前应将上述材料以附件形式发送至机构邮箱,经GCP办审核通过后再沟通启动会召开的时间与地点,确定启动会时间以邮件告知后机构办将安排相关人员参加启动会。严禁在启动会未召开的情况下筛选和入组受试者。
7、质量控制:CRA、CRC必须在项目启动前到机构备案(递交简历、身份证复印件、GCP培训证以及委托函),CRA需递交监查计划,GCP办将依据项目具体情况要求申办者开展第三方稽查。完成首例随机、入组过半数、关中心前,CRA需要及时预约机构项目管理员进行质控。
8、增加病例申请:试验过程中,经机构质控质量良好且在达到合同入组例数前,填写《增加病例申请表》(附件10),签署《增加病例申请表》方能继续筛选。
9、CRF回收和/或数据锁库:申办者或CRO需在临床试验项目最后一例受试者随访结束后,必须预约机构质控人员进行一次全面质控,对≥30%的CRF表和原始记录进行抽检,达到质控要求后方可回收CRF和/或进行数据锁库。
10、关中心监查访视:监查员在进行关中心的监查访视前,至少提前15天预约机构质控人员进行关中心前的质控,确认研究者文件夹中文件已按照《临床试验保存文件》(附件11)存档研究资料并完成《药物临床试验项目结题研究资料自查表》(附件12)、人类遗传资源研发活动排查信息表(附件13),试验用药品、仪器设备、物资耗材等均已退回申请方。(注:研究者文件夹可按照项目组保存目录整理,需在附件11中注释存于项目组目录位置)
11、资料归档:资料归档时须同时将《药物临床试验项目信息表》(附件14)、《专业药物临床试验结题自查报告》(附件15)、《药物临床试验自查核查质量控制表》(附件16)及《岳阳市中心医院临床试验项目分中心结题审核表》(附件17)交至机构办审核。如资料归档时不完整(如eCRF、总结报告),申请方应及时补充资料(注:关中心与归档附件(附件11-20)需将电子版发机构邮箱,纸质版递交机构)。
12、临床试验经费管理:
①立项费、合同款项等所有汇款均须在“用途”处备注机构立项编号,
②尾款结算:与PI确认临床试验费用以及CRC管理费(注:支付CRC管理费时需单独付款并备注CRC管理费)后将PI签字确认的《临床试验尾款结算说明函》(附件18)以及费用发票复印件递交至机构办。③退费流程:若申办者/CRO支付的研究费用超出临床试验实际产生的费用,需要申请退费,填写《退款申请函》(附件19),递交纸质版一式两份;并由付款方开具与退款金额等额的收据,上述文件递交至机构办审核,审核通过后协助退款。④发票领取流程:CRA(CRC)携带付款凭证(备注机构立项编号)前往GCP办登记领取电子发票)
13、分中心小结盖章:需先与机构办进行试验费用(主协议费用、CRC管理费)核算并完成付款、关中心前质控整改完成后,填写《试验报告、小结表盖章申请表》(附件20)进行分中心小结盖章。
14、联系方式:
机构办电话:0730-8357843
传 真:0730-8357843
机构办邮箱:YYSYGCP@126.com
机构办接收SUSAR邮箱:YYSYGCPSUSAR@126.com
机构办地址:湖南省岳阳市岳阳大道28号 岳阳市中心医院珍珠山院区门诊五楼565室(邮编414000)
15、机构组织代码:12430600446158291L
16、研究机构账户信息如下(甲方汇款需在用途或汇款附言处备注机构立项编号):
户 名:岳阳市中心医院
开户行:建设银行岳阳桥东支行
账 号:43001601066050000288
17、机构办公室人员:
孔 丽(机构办公室主任)电话:0730-8357843
刘宇峰(机构办公室秘书)电话:0730-8357843;17369410662
(负责全科医疗科、乳腺、麻醉科、眼科、耳鼻咽喉科、肾病学项目管理)
杨 平(项目管理员)电话:0730-8357843;18007309308
(负责免疫学、神经内科、肿瘤科、血液内科、骨科、皮肤科、妇科项目管理)
欧阳湛波(项目管理员)电话:0730-8357843;19973895297
(负责内分泌、心血管内科、呼吸内科、消化内科、传染科项目管理)
李 轶(药品管理员)电话:13975141111
18、药物临床试验专业及PI情况:
- 内分泌专业(PI:王晓岳、许露、罗长青、刘珊、孙清元)
- 消化内科专业(PI:陈卫星、何林方、汤雅静)
- 心血管内科专业(PI:潘港、冯小坚、杨佳)
- 肿瘤科(PI:胡建兵、翁洁、文芳、沈二栋、周强、罗盘、殷清华)
- 骨科专业(PI:沈为栋、彭伟)
- 神经内科专业(PI:李罗清、黄翔、杨秀娟、马艳、刘亚)
- 妇科专业(PI:吴喆)
- 呼吸内科专业(PI:黄玲媚)
- 传染科(PI:袁明娟)
- 乳腺专业(PI:肖君)
- 免疫学专业(PI:曾艳)
- 麻醉科(PI:张忠、肖如红)
- 全科医疗科(PI:张响华)
- 产科专业(PI:陶亮)
- 肝胆外科(PI:刘煜)
- 眼科(PI:杨阳)
- 耳鼻咽喉科(PI:朱华兵)
- 肾病学专业(PI:陈红)
- 普通外科专业(PI:华东)
- 血液内科专业(PI:孙华)
- 皮肤科(PI:黄辉云)
- I期药物临床试验(PI:文芳)